Dirbtinio intelekto srityje neretai sunku atskirti pasiektą pažangą nuo sukelto ažiotažo. Galbūt nugalėtas „Go“ ar kito žaidimo čempionas, sukurtas video žaidimas ir yra svarbus pasiekimas, bet reikia užduoti ir paprastą klausimą: ką iš tikrųjų padarė dirbtinio intelekto (DI) sistemos, ką būtų galima pritaikyti realiame pasaulyje?

Šią vasarą „DeepMind“ pateikė ko gero iki šiol geriausią atsakymą į šį klausimą per jau dešimtmečius trunkančią DI kūrimo ir tyrimų istoriją: šis Google padalinys paskelbė apie „AlphaFold“, programinės įrangos platformą, leidžiančią analizuoti baltymų formas, pasiekimus.
Viena iš didžiųjų gyvybės paslapčių
1972 metais Kristianas Anfinsenas (Christian Anfinsen) chemijos Nobelio premijos laureatas, savo kalboje pateikė istorinę prognozę: iš esmės turėtų būti įmanoma nustatyti baltymo trimatę formą, žinant vien tik jį sudarančių vienmačių aminorūgščių seką.
Tačiau šios prognozės, dar vadinamos „baltymų sulankstymo problema“, pavertimas realybe gerokai užtruko – visą pusę amžiaus tai buvo didžiulis iššūkis biologijos srityje, apibūdintas kaip vienas iš svarbiausių neatsakytų šiuolaikinio biologijos mokslo klausimų.
Tačiau dirbtinio intelekto sistema „AlphaFold“ šią problemą tiesiog išsprendė. Nors žodžio „išsprendė“ vartojimas biologų bendruomenėje sukėlė tam tikrų nesutarimų, dauguma šios srities ekspertų sutinka, kad „AlphaFold“ pasiekimą tikrai galima laikyti baltymų sulankstymo problemos sprendimu.
Kodėl baltymų sulankstymo problema yra tokia svarbi? Ir kodėl tai taip sunku išspręsti?
Baltymai yra pačiame gyvybės centre. Kaip sakė žymus biologas Arturas Leskas (Arthur Lesk), „gyvenimo dramoje molekuliniu mastu baltymai yra ten, kur vyksta veiksmas“.
Baltymai dalyvauja iš esmės visose svarbiose gyvybei procesuose, vykstančiose kiekvienoje gyvoje būtybėje: maisto virškinime, raumenų susitraukime, deguonies pernešime, kovoje su svetimais virusais ir bakterijoms.
Paprasčiau tariant, baltymai yra tokie svarbūs todėl, kad jie yra universalūs. Baltymai sugeba atlikti daugybę skirtingų funkcijų, daug daugiau nei kitų rūšių biomolekulės, kaip lipidai ar angliavandeniai. Šis neįtikėtinas universalumas yra tiesioginė pasekmė to, kokia yra baltymo forma.
Kiekvienas baltymas susideda iš eilės tarsi statybinių blokelių, vadinamų aminorūgštimis, kurios yra sujungtos tam tikra tvarka. Yra 20 skirtingų aminorūgščių tipų. Tam tikra prasme baltymų struktūra yra paprasta: kiekvienas baltymas gali būti apibūdintas jo vienmate aminorūgščių seka, o sekoje gali būti 20 skirtingų aminorūgščių. Baltymų ilgis gali būti nuo kelių dešimčių iki kelių tūkstančių aminorūgščių.
Tačiau baltymai nelieka vienmačiais. Kad jie taptų funkcionalūs, jie pirmiausia sulankstomi į sudėtingas trimates formas.
Baltymo forma yra glaudžiai susijusi su jo funkcija. Pavyzdžiui, antikūnų baltymai sulankstomi į formas, leidžiančias tiksliai identifikuoti ir sunaikinti svetimkūnius, baltymui į juos pakliūnant tarsi raktui į spyną. Taigi, norint suprasti, kaip veikia organizmai ir galiausiai, kaip veikia pati gyvybė, būtina žinoti formą, į kurią susilenks baltymai.
Tai yra didelis iššūkis: skirtingų konfigūracijų, į kurias baltymas gali sulankstyti pagal savo aminorūgščių seką, skaičius yra astronominis. Bet kuris baltymas teoriškai gali turėti maždaug 10300 skirtingų formų. Palyginimui, jei baltymas susisuktų į kiekvieną įmanomą formą, ją keisdamas milijoną kartų per sekundę, tai užtruktų ilgiau nei Visatos amžius, kol jis būtų įgijęs visas įmanomas formas. Tačiau kažkaip iš visų šių galimų konfigūracijų kiekvienas baltymas spontaniškai susilanksto į vieną konkrečią formą, kuri atitinka savo reikiamą biologinę paskirtį.
Žinoti, kokią formą įgaus baltymas yra absoliučiai būtina, norint suprasti biologinius procesus. Nenuostabu, kad baltymų sulankstymo problema dešimtmečius biologijoje buvo tarsi šventasis Gralis.
Tačiau buvo sukurta dirbtinio intelekto sistema „AlphaFold“. Jos žvaigždė sužibo 2020 metų lapkritį, kai buvo paskelbtas eilinis konkursas „Kritinis baltymų struktūros prognozavimo vertinimas“ (Critical Assessment of Protein Structure Prediction, CASP). Tai kas antrus metus rengiamas konkursas, kuris yra tarsi baltymų lankstymo olimpiada.
Varžybų formatas yra paprastas. Konkurso dalyviams pateikiami maždaug 100 baltymų, kurių trimatės struktūros buvo nustatytos eksperimentiniu būdu, bet jos dar nėra viešai paskelbtos, vienmatės aminorūgščių sekos. Naudodami aminorūgščių sekas kaip įvesties duomenis, konkurso dalyviai turi numatyti trimates baltymų struktūras, kurios vėliau lyginamos su eksperimentiškai nustatytosiomis.
Ir „AlphaFold“ pasirodymas šiame CASP konkurse buvo istorinis, užtemdęs visus kitus dalyvius ir jų metodus. „AlphaFold“ sistema sėkmingai numatė baltymų trimatę formą beveik vieno atomo tikslumu. Patys CASP konkurso organizatoriai pareiškė, kad baltymų lankstymo problema yra išspręsta.
Iki „AlphaFold“ mokslininkai žinojo tik apie 17% iš maždaug 20000 žmogaus kūno baltymų formų. Ir tos žinomos baltymų struktūros buvo dešimtmečius kruopščiai tiriamos laboratorijose, naudojant eksperimentinius metodus, tokius kaip rentgeno kristalografija ir branduolinis magnetinis rezonansas, kuriems reikalinga brangi įranga ir mėnesius ar net metus trunkantys tyrimai.
Tačiau staiga, „AlphaFold“ dėka, turime trimates baltymų struktūras beveik visam (98,5%) žmogaus kūno baltymų rinkiniui, arba proteomui. Iš jų 36% numatyti labai tiksliai, o dar 22% – vidutiniu tikslumu.
CASP konkurso įkūrėjų teigimu, tai pirmas kartas, kai dirbtinis intelektas išsprendė rimtą mokslinę problemą.
Biologas Andrejus Lupas (Andrei Lupas ) teigia dar daugiau: „Tai pakeis mediciną. Tai pakeis tyrimus. Tai pakeis bioinžineriją. Tai viską pakeis“. „AlphaFold“ jau leido jo laboratorijai nustatyti baltymo, kurį nesėkmingai mėgino ištirti beveik dešimtmetį, struktūrą.
Kaip „DeepMind“ pasiekė šį istorinį rezultatą?
Kaip ir daugelio mašininio mokymosi sistemose, viskas prasideda nuo duomenų, kuriuos analizuodama sistema mokosi. „AlphaFold“ buvo apmokyta naudojant keletą skirtingų viešai prieinamų baltymų duomenų rinkinių; labai padėjo, kad daug svarbių šios srities duomenų yra atviros prieigos. Baltymų duomenų bankas (Protein Data Bank, PDB) yra duomenų bazė, kurioje yra beveik visų baltymų, kurių struktūrą jau nustatė žmonija, trimatės formos ir susijusios aminorūgščių sekos – iš viso apie 180000 baltymų, apimančių žmogaus ir kitų gyvų organizmų baltymus. Kitoje duomenų bazėje, UniProt, yra beveik dviejų šimtų milijonų baltymų aminorūgščių sekos, tačiau be jų struktūrų.
„AlphaFold“ tyrėjai sukūrė naujo tipo DI sistemą, kurią jie pavadino „Invariant Point Attention“ (IPA), specialiai skirtą dirbti su trimatėmis formomis. Ji leidžia maksimaliai padidinti informacijos srautą kiekviename analizės žingsnyje – formos prognozės yra daug kartų persiunčiamos pirmyn ir atgal tarp „AlphaFold“ komponenčių, leidžiančių visai sistemai kurti vis tikslesnį baltymo struktūros prognozavimą.
Ir, kas ne mažiau svarbu, „AlphaFold“ mokymui ir darbui reikalinga skaičiavimo galia nėra didelė – tai leido tiek inovatyvi programinė įranga, tiek ir „DeepMind“ sukurtos kelios svarbios mašininio mokymosi naujovės.
Tačiau reikia pažymėti, kad „AlphaFold“ turi ir reikšmingų apribojimų. Jos prognozės ne visada yra tokios tikslios, kaip trimatės formos, nustatytos tradiciniais eksperimentiniais metodais. Ji numato vieną stabilią formą vienam baltymui, tačiau baltymai yra dinamiški ir judėdami per kūną gali formą pakeisti. Baltymai, neturintys stabilios formos ar sudaryti iš nenatūralių aminorūgščių gali „apgauti“ „AlphaFold“. „AlphaFold“ gali kurti prognozes apie atskiras baltymų struktūras, tačiau mažai kuo gali padėti tiriant kelių baltymų kompleksus, baltymų ir DNR sąveikas, baltymų ir mažų molekulių sąveikas ir panašius dinaminius procesus, kurių supratimas yra būtinas norint suprasti daugelį gyvybės veikimo procesų. Ir kadangi „AlphaFold“ išmoko prognozuoti, remdamasi savo mokymosi duomenimis (kaip ir bet kuri DI sistema), jai būtų sunku numatyti neįprastų naujų baltymų formas, įskaitant ir tokius baltymus, kurių nėra gamtoje.
Tačiau čia reikia turėti omenyje ir platesnį aspektą: kai tik bus išspręsti šiandienos iššūkiai, kurių „AlphaFold“ dar nesugeba įveikti, šie sprendimai neabejotinai bus panaudoti tobulinant sistemą. O progresas gali būti greitas – jau dabar viena Harvardo universiteto laboratorija paskelbė apie reikšmingus „AlphaFold“ darbo patobulinimus.
Tuo tarpu „DeepMind“ paskelbė, kad jų kitas žingsnis – kurti sistemą, kuri prognozuotų baltymų kompleksų formas.
Svarbus „AlphaFold“ istorijos etapas įvyko 2021 metų liepos mėnesį – „DeepMind“ paskelbė, kad „AlphaFold“ tapo atvirojo kodo sistema, taip pat bus viešai prieinami jos darbo rezultatai. Internete atverta duomenų bazė https://alphafold.ebi.ac.uk/, kurioje yra daugiau nei 350000 baltymų trimatės struktūros. Joje yra beveik visi žmogaus baltymai, taip pat 20 kitų mokslui svarbių rūšių, tokių kaip vaisinė muselė ir pelė, baltymų struktūros. „DeepMind“ tyrėjai žurnale „Nature“ paskelbė du straipsnius, kuriuose išsamiai aprašė tyrimų metodiką.
Palyginimui, iki „AlphaFold“ visa žmonija bendromis pastangomis išsiaiškino maždaug 180000 baltymų trimatę struktūrą.
Ir tai tik pradžia. „DeepMind“ sako, kad planuoja ištirti ir paskelbti daugiau nei šimto milijonų baltymų struktūras, t.y. beveik kiekvieną baltymą, kurio seka yra žinoma mokslui. Ekspertų teigimu, tai gali būti vienas svarbiausių duomenų rinkinių po žmogaus genomo kartografavimo.
„DeepMind“ sprendimo dėl atvirojo kodo „AlphaFold“ pasekmes sunku pervertinti. Kaip rodo technologijų istorija, atviros inovacijos yra pačios efektyviausios. Nuo paskirstytojo kūrybiškumo, kurį prieš trisdešimt metų išlaisvino internetas, iki atviro kodo programinės įrangos, tokios kaip „Linux“ sėkmės, tikri technologijų plėtros pliūpsniai įvyksta, kai į jų vystymą gali įsitraukti ir prisidėti visi norintys, o ne tik mažos uždaros grupės. Kaip sakė „Sun Microsystems“ įkūrėjas Bilas Joy: „Nesvarbu, kas tu esi, dauguma protingiausių žmonių vis vien dirba kažkam kitam“.
Naudojant atviro kodo „AlphaFold“, aplink ją atsiras visa biotechnologijų tyrimų ir startuolių ekosistema. Niekas negali numatyti daugybės skirtingų krypčių, kurias pasieks naujovės, kai vienu mygtuko paspaudimu bus laisvai prieinami duomenys apie milijonų baltymų struktūrų.
Naudodama „AlphaFold“, Boulderio universiteto tyrėjai jau sugebėjo nustatyti ypač sudėtingą bakterijos baltymo struktūrą – tai atradimas, kuris padės kovoti su atsparumu antibiotikams. Jie jau daugelį metų nesėkmingai bandė nustatyti šio baltymo struktūrą, o su „AlphaFold“ rezultatą gavo vos per 15 minučių.
Kalbant apie komercines galimybes, yra bent dvi sritys, kurioms „AlphaFold“ galės padėti: naujų vaistų kūrimas ir baltymų kūrimas.
Kuriant naują vaistą, paprastai reikia nustatyti organizme esantį junginį – dažniausiai baltymą, kurį norite paveikti, ir tada surasti molekulę (vaistą), kuri sėkmingai prisijungs prie to baltymo. Šiame procese būtina žinoti baltymo – taikinio – trimatę formą, nes baltymo forma nustato, kokios ir kaip kitos molekulės prie jo gali prisijungti. Čia ir padėtų „AlphaFold“.
Dar viena potenciali sritis – retos ligos. Joms tirti skiriamas nedidelis mokslinių tyrimų finansavimas, dažnai dėl to, kad šia liga serga labai mažai žmonių arba paveiktos populiacijos tiesiog negalėtų įsigyti naujų vaistų. „AlphaFold“ padėtų suvienodinti sąlygas ieškant vaistų nuo šių ligų, nes reikiamų baltymų struktūros būtų greitai surastos, be brangaus darbo laboratorijose.
„DeepMind“ jau paskelbė apie partnerystę su ne pelno siekiančia organizacija „Drugs for Neglected Diseases Initiative“, siekiančia skatinti vaistų kūrimą tokioms ligoms.
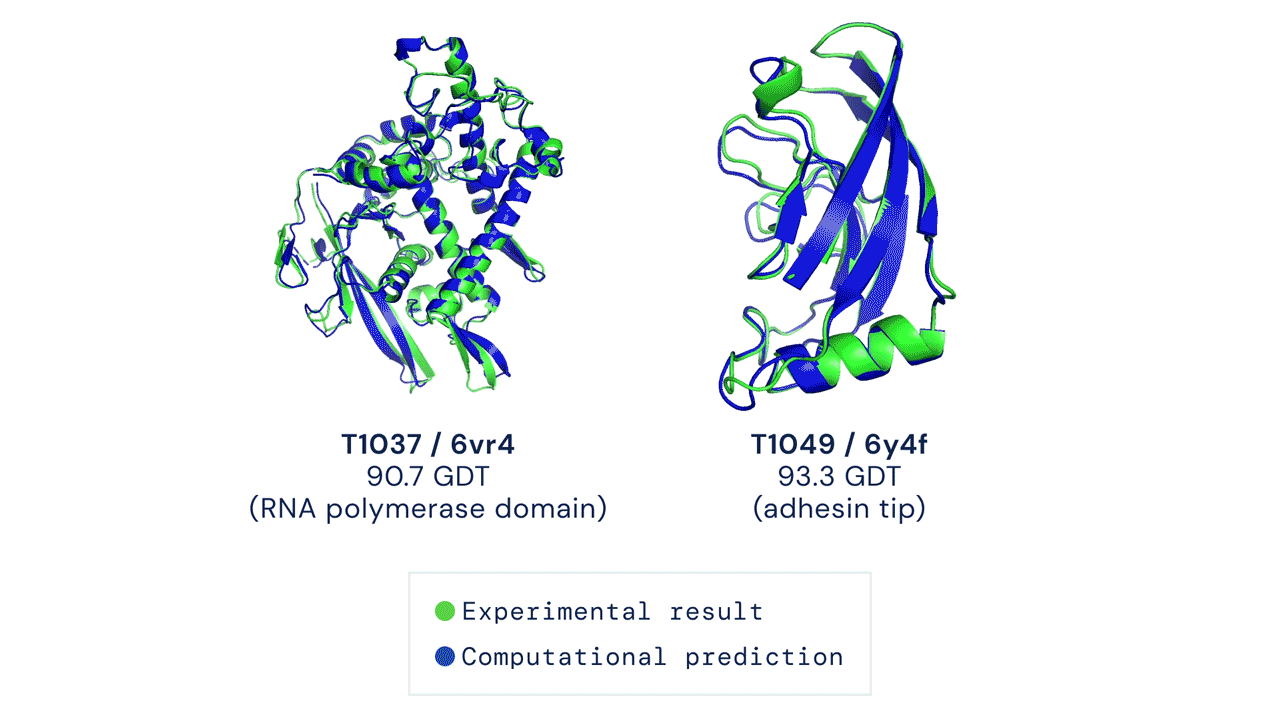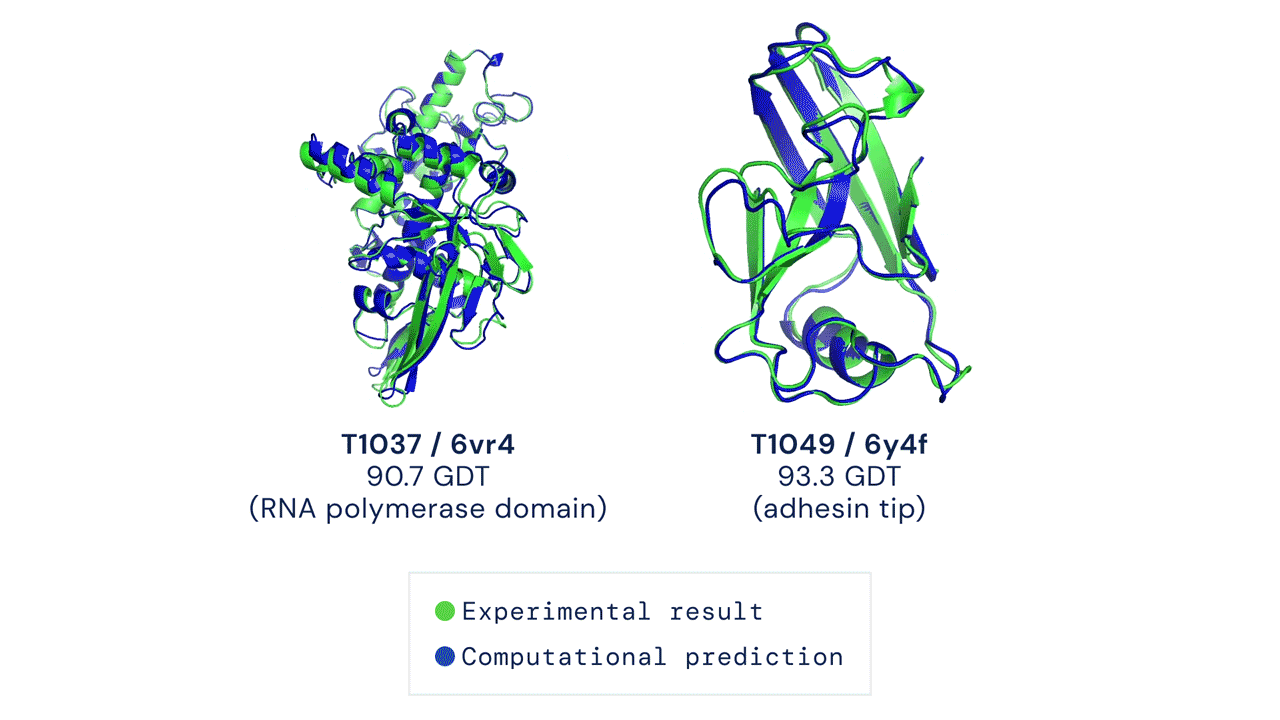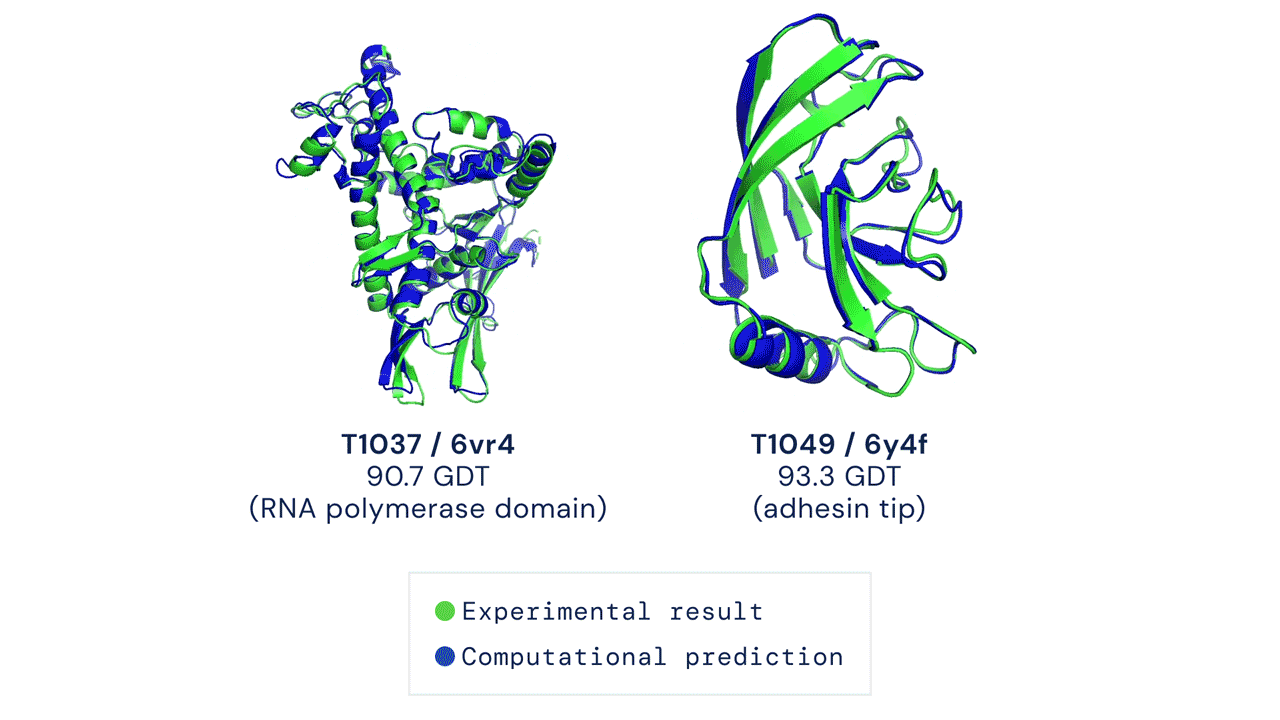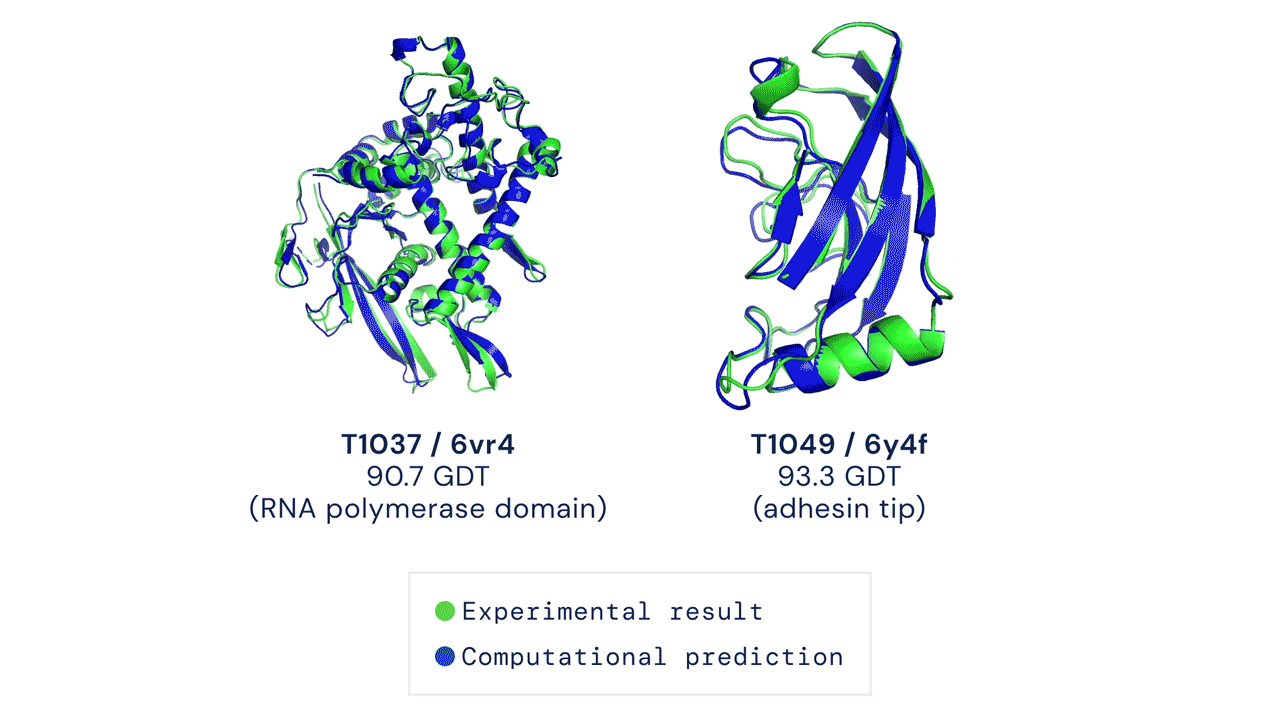
Tačiau „AlphaFold“ dar greitai nepakeis naujų vaistų kūrimo procesų. Tam yra kelios priežastys – „AlphaFold“ prognozuojamos struktūros ne visada yra tikslios ir nepakankamos skiriamosios gebos, ypač kai kalbama apie aktyvias baltymų surišimo vietas. Be to, tai, kad „AlphaFold“ numato pavienių baltymų struktūras, yra pagrindinis apribojimas: svarbiausia, ką reikia suprasti kuriant vaistus, yra baltymų ir vaistų sąveika. Sistemos, skirtos baltymų ir vaistų struktūroms prognozuoti, sukūrimas yra daug didesnis uždavinys nei atskirų baltymų formos numatymas.
Be abejo, ir tinkamos aktyvios medžiagos atradimas yra tik pirmas žingsnis labai ilgame ir brangiame naujo vaisto kūrimo procese. Nors „AlphaFold“ gali padėti pagreitinti ši pradinį etapą, ji negali padėti spartinti kitų, pavyzdžiui klinikinių tyrimų.
Bet baltymų tyrinėtojai mato ir kitą sritį – galimybes kurti naujus baltymus.
Teoriškai gali būti sukurta didžiulė baltymų duomenų bazė, iš kurių tik mažoji dalis atsirado gamtoje dėl natūralios evoliucijos. Tyrinėdami šią neapibrėžtą visumą galimų struktūrų, kurių nėra gamtoje, mokslininkai galėtų sukurti naujų baltymų, pritaikytų konkrečioms reikmėms, pavyzdžiui, kovai su ligomis.
Čia „AlphaFold“ gali būti galinga priemonė. Pavyzdžiui, ji galėtų patikrinti, ar konkretus naujas baltymas iš tikrųjų susilankstytų į reikiamą trimatę formą – iki „AlphaFold“ tai buvo brangu ir reikalavo daug laiko. Naudojant „AlphaFold“, būtų nesunku susieti aminorūgščių sekas su norima hipotetine trimate struktūra, ir leisti sistemai patikrinti, kokia būtent seka suformuotų tokį baltymą.
„DeepMind“ ir Jungtinės Karalystės Portsmuto universitetas neseniai paskelbė apie partnerystę naudojant „AlphaFold“, siekiant sukurti naujų tipų baltymus, kurie efektyviau skaidytų plastiko atliekas.
Jau yra teigiančių, kad „AlphaFold“ pasiekimai „DeepMind“ tyrėjams ateityje gali atnešti ir Nobelio premiją.
Europos molekulinės biologijos laboratorijos (The European Molecular Biology Laboratory, EMBL), ne pelno siekiančios mokslinių tyrimų organizacijos teigimu, „AlphaFold “suteiks naujų įžvalgų apie gyvybinius procesus, susijusius su sveikata ir ligomis, pritaikant juos biotechnologijose, medicinoje, žemės ūkyje, maisto pramonėje ir bioinžinerijoje, bet tikriausiai prireiks vieno ar dviejų dešimtmečių, kol bus tinkamai įvertintas šio pasiekimo ir jo tolesnio vystymo poveikis“.
Daugiau:
Dirbtinio intelekto sistema jau gali išversti anglų kalbos tekstą į programinį kodą
Kompanijos „DeepMind“ vadovas pripažįsta, kad dirbtinio intelekto sistemos kelia ir rizikas
Dirbtinio intelekto sistemos tampa universalesnėmis
Ar dirbtinis intelektas galės atpažinti COVID-19 ir kitus susirgimus?
